Milho
Manejo Integrado de Pragas
Autores
José Magid Waquil
Paulo Afonso Viana - Embrapa Milho e Sorgo
Ivan Cruz - Embrapa Milho e Sorgo
A definição de MIP (Manejo Integrado de Pragas) adotada por um painel organizado pela FAO (Organização das Nações Unidas para Agricultura e Alimentação) enuncia: "Manejo Integrado de Pragas é o sistema de manejo de pragas que no contexto associa o ambiente e a dinâmica populacional da espécie, utiliza todas as técnicas apropriadas e métodos de forma tão compatível quanto possível e mantém a população da praga em níveis abaixo daqueles capazes de causar dano econômico."
Os fundamentos, tanto do Controle Integrado como do Manejo Integrado de Pragas, baseiam-se em quatro elementos: na exploração do controle natural, dos níveis de tolerância das plantas aos danos causados pelas pragas, no monitoramento das populações para tomadas de decisão e na biologia e ecologia da cultura e de suas pragas. Estas premissas implicam no conhecimento dos fatores naturais de mortalidade, nas definições das densidades populacionais ou da quantidade de danos causados pelas espécies-alvo equivalentes aos níveis de dano econômico (NDE) e de controle (NC), que fica imediatamente abaixo do NDE. Outra variável importante seria a determinação do nível de equilíbrio (NE) das espécies que habitam o agroecossistema em questão.
Em função da flutuação da densidade da espécie-alvo e de sua posição relativa a esses três níveis (NE, NDE E NC) ao longo do tempo, as espécies podem ser classificadas em pragas-chave (densidade populacional sempre acima do NDE), pragas esporádicas (densidade na lavoura raramente atinge o NDE) e não-pragas (a densidade da espécie em questão nunca atinge o NDE). Mais recentemente, tem sido proposto também o nível de não-controle (NNC), ou seja, a densidade populacional de uma ou mais espécies de inimigos naturais capaz de reduzir a população da espécie-alvo a níveis não econômicos, dispensando, assim, a utilização de medidas de controle.
Monitoramento
O monitoramento é o primeiro passo para se praticar o MIP. Sem monitorar a densidade populacional da espécie-alvo no campo não há como se aplicar os princípios do MIP. Assim, recomenda-se iniciar o monitoramento mesmo antes de se iniciar o plantio. A frequência e o método de amostragem depende da fase de desenvolvimento da cultura e do nível de precisão que se pretende conduzir o manejo. Quanto maiores a frequência e tamanho da amostra, melhor. Entretanto, deve-se considerar também os custos dessas amostragens.
Monitoramento de pragas de solo
Deve-se examinar amostras de solo de 30 cm x 30 cm por 15 cm de profundidade utilizando-se uma peneira e procurando por insetos. Para a larva-arame, medidas de controle devem ser adotadas se dois ou mais insetos forem detectadas por amostra. A média de uma larva por amostra é suficiente para causar dano significativo. Neste caso, a proteção da semente com inseticida é uma estratégia que propicia retorno ao agricultor.
Para a simples detecção da presença de insetos no campo, pode-se proceder da seguinte maneira: tomar cerca de 200 g de sementes sem tratamento e enterrar em locais, com identificação, dentro da área a ser cultivada e cobrir com um pedaço de plástico transparente. Alguns dias depois, desenterrar o material e procurar por insetos.
No caso específico de cupins subterrâneos, o exame de restos culturais, como pedaços de colmos ou sabugos de milho da cultura anterior, pode dar um bom indicativo da presença da praga no cultivo seguinte. Uma outra estratégia é enterrar os restos culturais ou mesmo um rolo de papel higiênico (sem cor e perfume) em pontos estratégicos e, após alguns dias, examinar o material visando detectar a presença de insetos.
Monitoramento de pragas de plântulas e de plantas mais desenvolvidas
Considerando a eficiência do tratamento de sementes, se essa prática foi realizada, o levantamento pode ser iniciado a partir da terceira semana após a semeadura do milho. A detecção de cigarrinhas pode ser feita através de exame direto ou utilizando-se rede entomológica. Para se estimar densidades com maior precisão pode-se usar o método do saco plástico. Neste caso, se em áreas e/ou em condições de risco de incidência de enfezamentos e viroses, recomenda-se fazer o controle quando detectado a presença dos insetos. No entanto, a utilização de cultivares com grau elevado de resistência às doenças transmitidas por insetos é a estratégia principal para se evitar os prejuízos.
Para a lagarta-elasmo e lagarta-rosca, deve-se estimar a incidência contando-se o número de plantas atacadas em 10 m de fileira e adotar medidas de controle em função do nível de dano. Em regiões onde haja histórico de ocorrência dessas pragas, o tratamento de sementes pode ser a melhor estratégia de controle, considerando a severidade das espécies.
Para a broca da cana-de-açúcar, um problema mais recente no milho, é de suma importância a detecção da praga na área, pois muitas vezes os sintomas de ataque só são verificados em plantas mais desenvolvidas, época em que a entrada de medidas convencionais de controle não são eficientes.
Para o controle da lagarta-do-cartucho, pode ser utilizada a amostragem do número de plantas atacadas em cinco pontos ao acaso dentro de uma área de um hectare. Para lavouras com potencial para no mínimo 100 sacos de milho, a presença de 10% de plantas com sintomas iniciais de ataque da praga já indica a necessidade de medidas de controle. Existem recomendações de amostragens sequenciais. Para áreas mais extensas, a utilização de armadilhas contendo feromônio sexual com atraente de mariposas tem sido um método preciso para ajudar na decisão de quando entrar com medidas de controle da praga.
Algumas estratégias de manejo
Tratamento de sementes
O tratamento de sementes é uma prática que tem sido largamente difundida nos últimos anos visando o controle de pragas subterrâneas e iniciais da cultura do milho em áreas que apresentam histórico de problemas oriundos de ataques de determinados grupos de insetos (ver sessões de pragas subterrâneas e iniciais). Os danos causados por essas pragas resultam em falhas na lavoura devido à sua alimentação, nas sementes após a semeadura, nas raízes após a germinação, e na parte aérea de plantas recém-emergidas. Tem-se como ponto primordial para se obter alta produtividade na lavoura o estabelecimento de um número ideal de plantas por área para que tal fato se suceda. Em lavoura com baixo estande, a utilização dos demais insumos não contribuirão para que o agricultor obtenha a rentabilidade esperada da lavoura.
No tratamento de sementes, uma quantidade relativamente pequena de ingrediente ativo aplicado sobre as sementes, protegem-nas no solo até a germinação, bem como as raízes e a parte aérea da planta logo após a sua emergência. O seu emprego, muitas vezes, reduz a necessidade de pulverizações de plantas recém-emergidas com inseticidas de custos elevados e que geralmente, na aplicação, não atingem o alvo devido à pequena área foliar das plantas em pós-emergência. Portanto, a prática contribui para reduzir o impacto negativo no ecossistema, uma vez que não afeta diretamente os inimigos naturais que estão se estabelecendo nesta fase de desenvolvimento da cultura.
A técnica ainda apresenta a vantagem de seu uso ser relativamente fácil e em alguns casos, de baixo custo. Atualmente, existe uma variação bastante grande nos preços de inseticidas, na toxicidade e na eficiência no tratamento de sementes. Tem-se observado que determinados grupos de inseticidas possibilitam melhor controle de lagartas (elasmo, lagarta-rosca), outros apresentam melhor desempenho para insetos sugadores (percevejo-castanho, percevejo barriga-verde, percevejo-preto), térmitas (cupins) e, finalmente, larvas de coleópteros (bicho-bolo, larva-arame, larva-alfinete). Para cada caso, a escolha do inseticida deve estar em consonância com os registros no Ministério da Agricultura, Pecuária e Abastecimento (Tabela 1).
Tabela 1. Inseticidas registrados para o controle de insetos-praga na cultura do milho. 2002
|
Praga |
Ingrediente ativo |
Nome comercial |
Form. |
C.TOX. |
Dose (p.c./ha) |
Fabricante |
|
Agrotis ipsilon |
carbaryl |
Carbaryl Fersol 480 SC |
SC |
II |
2,0 - 3,0 l |
Fersol |
|
|
|
Carbaryl Fersol Pó 75 |
DP |
III |
15,0 - 20,0 kg |
Fersol |
|
|
carbofuran |
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Ralzer 350 SC |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
Fersol |
|
|
terbufos |
Counter 150 G |
GR |
I |
13,0 kg |
Basf |
|
|
|
Counter 50 G |
GR |
I |
40,0 kg |
Basf |
|
|
chlorpyrifos |
Lorsban 480 BR |
EC |
II |
1,0 l |
Dow AgroSciences |
|
|
|
Vexter |
EC |
II |
1,0 l |
Dow AgroSciences |
|
|
cypermethrin |
Galgotrin |
EC |
II |
0,06 l |
Chemotécnica Sintyal |
|
|
lambdacyhalothrin |
Karate Zeon 250 CS |
CS |
III |
0,01 l |
Syngenta |
|
|
permethrin |
Pounce 384 CE |
EC |
II |
0,01 - 0,013 l |
FMC |
|
Astylus variegatus |
carbofuran |
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg |
sem. |
|
Cornitermes snyderi |
carbofuran |
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Furazin 310 TS |
SC |
I |
2,25 l/100 kg sem. |
FMC |
|
|
carbosulfan |
Marshal TS |
SC |
II |
2,0 - 2,8 l/100 kg sem. |
FMC |
|
|
|
Marzinc 250 TS |
DS |
II |
2,0 kg/100 kg sem. |
FMC |
|
Daubulus maidis |
imidaclorprid |
Gaucho FS |
SC |
IV |
0,8 l |
Bayer |
|
|
thiomethoxan |
Cruiser |
DP |
III |
0,15 - 0,2 kg/100 kg sem. |
Syngenta |
|
Deois flavopicta |
carbofuran |
Diafuran 50 |
GR |
I |
20,0 kg |
Hokko |
|
|
carbosulfan |
Marshal TS |
FS |
II |
2,4 - 2,8 l/100 kg sem. |
FMC |
|
|
imidacloprid |
Gaucho FS |
FS |
IV |
0,6 l/100 kg sem. |
Bayer |
|
|
thiamethoxan |
Cruiser 700 WS |
WS |
III |
0,15 - 0,20 kg/100 kg sem. |
Syngenta |
|
|
thiodicarb |
Semevin 350 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
Diabrotica speciosa |
chlorpyrifos |
Astro |
EW |
III |
2,6 l |
Bayer |
|
|
|
Lorsban 10 G |
GR |
IV |
11,0 kg |
Dow AgroSciences |
|
|
|
Sabre |
EW |
III |
2,6 l |
Dow AgroSciences |
|
|
fipronil |
Regente 800 WG |
WG |
II |
0,1 kg |
Aventis |
|
|
imidacloprid |
Gaucho |
WP |
IV |
0,7 kg/100 kg sem. |
Bayer |
|
|
phorate |
Granutox 150 G |
GR |
II |
17 kg |
Basf |
|
|
terbufos |
Counter 50 G |
GR |
I |
40 kg |
Basf |
|
|
|
Counter 150 G |
GR |
I |
13 kg |
Basf |
|
Dichelops furcatus |
imidacloprid |
Gaucho FS |
SC |
IV |
0,35 l/100 kg sem. |
Bayer |
|
|
thiamethoxan |
Cruiser 700 WS |
DP |
III |
0,3 kg/100 kg sem. |
Syngenta |
|
Diloboderus abderus |
thiodicarb |
Futur 300 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
|
|
Semevin 350 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
Elasmopalpus lignosellus |
carbaryl |
Carbaryl Fersol 480 SC |
SC |
II |
2,0 - 2,3 l |
Fersol |
|
|
|
Carbaryl Fersol Pó 75 |
DP |
III |
15,0 - 20,0 kg |
Fersol |
|
|
|
Sevin 480 SC |
SC |
II |
1,9 - 2,25 l |
Aventis |
|
|
carbofuran |
Carbofuran Sanachem 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
Dow AgroSciences |
|
|
|
Carboran Fersol 350 SC |
SC |
I |
2,0 l/100 kg sem. |
Fersol |
|
|
|
Diafuran 50 |
GR |
I |
30 kg |
Hokko |
|
|
|
Furandan 350 SC |
SC |
I |
3,0 - 4,0 l |
FMC |
|
|
|
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Furadan 50 G |
GR |
III |
30,0 kg |
FMC |
|
|
|
Furazin 310 TS |
SC |
I |
2,25 l/100 kg sem |
FMC |
|
|
|
Ralzer 350 SC |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
Fersol |
|
|
|
Ralzer 50 GR |
GR |
I |
30,0 kg |
Fersol |
|
|
carbosulfan |
Marshal TS |
SC |
II |
2,4 - 2,8 l/100 kg sem. |
FMC |
|
|
|
Marzinc 250 TS |
DP |
II |
2,0 kg/100 kg sem. |
FMC |
|
|
chlorpyrifos |
Lorsban 480 BR |
EC |
II |
1,0 l |
Dow AgroSciences |
|
|
|
Vexter |
EC |
II |
1,0 l |
Dow AgroSciences |
|
|
furathiocarb |
Promet 400 CS |
SL |
III |
1,6 l/100 kg sem. |
Syngenta |
|
|
thiodicarb |
Futur 300 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
|
|
Semevin 350 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
Frankliniella williamsi |
imidacloprid |
Gaucho FS |
SC |
IV |
0,8 l/100 kg sem. |
Bayer |
|
Helicoverpa zea |
carbaryl |
Carbaryl Fersol 480 SC |
SC |
II |
2,0 - 2,3 l |
Fersol |
|
|
|
Carbaryl Fersol Pó 75 |
DP |
III |
15,0 - 20,0 kg |
Fersol |
|
|
|
Sevin 480 SC |
SC |
II |
1,90 - 2,25 l |
Aventis |
|
|
parathion-methyl |
Bravik 600 CE |
EC |
I |
0,45 - 0,67 l |
Action |
|
|
trichlorphon |
Dipterex 500 |
SL |
II |
0,8 - 2,0 l |
Bayer |
|
|
|
Trichorfon 500 Milena |
SL |
II |
1,0 - 2,0 l |
Milenia |
|
Mocis latipes |
carbaryl |
Carbaryl Fersol 480 SC |
SC |
II |
2,0 - 2,3 l |
Fersol |
|
|
|
Carbaryl Fersol Pó 75 |
PD |
III |
15,0 - 20,0 kg |
Fersol |
|
|
|
Sevin 480 SC |
SC |
II |
1,9 - 2,,25 l |
Aventis |
|
|
chlorpyrifos |
Lorsban 480 BR |
EC |
II |
0,6 l |
Dow AgroSciences |
|
|
|
Vexter |
EC |
II |
0,6 l |
Dow AgroSciences |
|
|
malathion |
Malathion 500 CE Sultox |
EC |
III |
2,5 l |
Action |
|
|
parathion-methyl |
Bravik 600 CE |
EC |
I |
0,45 - 0,675 l |
Action |
|
|
|
Folisuper 600 BR |
EC |
I |
0,25 - 0,65 l |
Agripec |
|
|
trichlorphon |
Dipterex 500 |
SL |
II |
0,8 - 2,0 l |
Bayer |
|
|
|
Triclorfon 500 Milenia |
SL |
II |
1,0 - 2,0 l |
Milenia |
|
Procornitermes triacifer |
benfuracarb |
Laser 400 SC |
SC |
II |
1,75 - 2,5 l/100 kg sem. |
Iharabras |
|
|
|
Oncol Sipcam |
SC |
II |
1,75 - 2,5 l/100 kg sem. |
Sipcam |
|
|
carbofuran |
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Furazin 310 TS |
SC |
I |
2,25 l/100 kg sem. |
FMC |
|
|
carbosulfan |
Marshal TS |
SC |
II |
2,0 - 2,8 l/100 kg sem. |
FMC |
|
|
|
Marzinc 250 TS |
DS |
II |
2,0 kg/100 kg sem. |
FMC |
|
|
imidacloprid |
Gaucho FS |
FS |
IV |
0,25 l/100 kg sem. |
Bayer |
|
|
terbufos |
Counter 50 G |
GR |
I |
40 kg |
Basf |
|
|
|
Counter 150 G |
GR |
I |
13 kg |
Basf |
|
Rhopalosiphum maidis |
imidacloprid |
Gaucho FS |
SC |
IV |
0,8 l/100 kg sem. |
Bayer |
|
Scaptocoris castanea |
terbufos |
Counter 50 G |
GR |
I |
40 kg |
Basf |
|
|
|
Counter 150 G |
GR |
I |
13 kg |
Basf |
|
Spodoptera |
alpha-cypermethrin |
Fastac 100 SC |
SC |
III |
0,05 l |
Basf |
|
frugiperda |
beta-cyfluthrin |
Bulldock 125 SC |
SC |
II |
0,04 l |
Bayer |
|
|
|
Full |
EC |
II |
0,1 l |
Bayer |
|
|
|
Novapir |
EC |
II |
0,1 l |
Cheminova |
|
|
|
Turbo |
EC |
II |
0,1 l |
Bayer |
|
|
carbaryl |
Carbaryl Fersol 480 SC |
SC |
II |
2,0 - 2,3 l |
Fersol |
|
|
|
Carbaryl Fersol Pó 75 |
DP |
III |
15,0 - 20,0 kg |
Fersol Ltda. |
|
|
|
Sevin 480 SC |
SC |
II |
1,9 - 2,25 l |
Aventis |
|
|
carbofuran |
Carbofuran Sanachem 350 TS |
SC |
I |
2,0 - 3,0 l |
Dow AgroSciences |
|
|
|
Carboran Fersol 350 SC |
SC |
I |
2,0 kg/100 kg sem. |
Fersol |
|
|
|
Diafuran 50 |
GR |
I |
20,0 - 30,0 kg |
Hokko |
|
|
|
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Furadan 50 G |
GR |
III |
20,0 - 30,0 kg |
FMC |
|
|
|
Ralzer 350 SC |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
Fersol |
|
|
|
Ralzer 50 GR |
GR |
I |
20,0 - 30,0 kg |
Fersol |
|
|
chlorfenapyr |
Pirate |
SC |
III |
0,5 - 0,75 l |
Basf |
|
|
chlorfluazuron |
Atabron 50 CE |
EC |
I |
0,15 - 0,3 l |
Ishihara |
|
|
chlorpyrifos |
Astro |
EW |
III |
0,3 - 0,5 l |
Bayer |
|
|
|
Clorpirifós Fersol 480 CE |
EC |
II |
0,4 - 0,6 l |
Fersol |
|
|
|
Clorpirifos Sanachem 480 CE |
EC |
I |
0,4 - 0,6 l |
Dow AgroSciences |
|
|
|
Klorpan 480 CE |
EC |
II |
0,4 - 0,6 l |
Agripec |
|
|
|
Lorsban 480 BR |
EC |
II |
0,4 - 0,6 l |
Dow AgroSciences |
|
|
|
Nufos 480 CE |
EC |
III |
0,4 - 0,6 l |
Cheminova |
|
|
|
Pyrinex 480 CE |
EC |
II |
0,4 l |
Agricur |
|
|
|
Sabre |
EW |
III |
0,3 - 0,5 l |
Dow AgroSciences |
|
|
|
Vexter |
EC |
II |
0,4 - 0,6 l |
Dow AgroSciences |
|
|
cyfluthrin |
Baytroid CE |
EC |
III |
0,3 l |
Bayer |
|
|
cypermethrin |
Arrivo 200 CE |
EC |
III |
0,05 - 0,08 l |
FMC |
|
|
|
Cipermetrina Nortox 250 CE |
EC |
I |
0,04 - 0,065 l |
Nortox |
|
|
|
Cipertrin |
EC |
II |
0,05 - 0,06 l |
Prentiss |
|
|
|
Commanche 200 CE |
EC |
III |
0,05 - 0,06 l |
FMC |
|
|
|
Cyptrin 250 CE |
EC |
I |
0,05 - 0,06 l |
Agripec |
|
|
|
Galgotrin |
EC |
II |
0,05 l |
Chemotécnica Sintyal |
|
|
|
Ripcord 100 |
EC |
II |
0,1 l |
Basf |
|
|
deltamethrin |
Decis 25 CE |
EC |
III |
0,2 l |
Aventis |
|
|
|
Decis 4 UBV |
UL |
III |
1,3 - 2,0 l |
Aventis |
|
|
|
Decis 50 SC |
SC |
IV |
0,05 - 0,075 l |
Aventis |
|
|
|
Decis Ultra 100 CE |
EC |
I |
0,04 - 0,05 l |
Aventis |
|
|
|
Keshet 25 CE |
EC |
I |
0,2 l |
Agricur |
|
|
deltamethrin + triazophos |
Deltaphos |
EC |
I |
0,25 - 0,35 l |
Aventis |
|
|
diflubenzuron |
Dimilin |
WP |
IV |
0,1 kg |
Uniroyal |
|
|
enxofre |
Kumulus DF |
WG |
IV |
1,0 kg |
Basf |
|
|
esfenvalerate |
Sumidan 25 CE |
EC |
I |
0,6 - 0,8 l |
Sumitomo |
|
|
etofenprox |
Trebon 300 CE |
EC |
III |
0,07 - 0,1 l |
Sipcam |
|
|
fenitrothion |
Sumibase 500 CE |
EC |
II |
1,0 - 2,0 l |
Sumitomo |
|
|
|
Sumithion 500 CE |
EC |
II |
1,0 - 1,5 l |
Sumitomo |
|
|
fenpropathrin |
Danimen 300 CE |
EC |
I |
0,1 - 0,12 l |
Sumitomo |
|
|
furathiocarb |
Promet 400 CS |
SL |
III |
1,6 l/100 kg sem. |
Syngenta |
|
|
lambda-cyhalothrin |
Karate 50 CE |
EC |
II |
0,15 l |
Syngenta |
|
|
|
Karate Zeon 250 CS |
CS |
III |
0,03 l |
Syngenta |
|
|
|
Karate Zeon 50 CS |
CS |
III |
0,15 l |
Syngenta |
|
|
lufenuron |
Match CE |
EC |
IV |
0,3 l |
Syngenta |
|
|
malathion |
Malathion 500 CE Sultox |
EC |
III |
2,5 l |
Action |
|
|
methomyl |
Lannate BR |
SL |
I |
0,6 l |
Du Pont |
|
|
|
Lannate Express |
SL |
II |
0,6 l |
Du Pont |
|
|
|
Methomex 215 LS |
SL |
II |
0,6 l |
Agricur |
|
|
methoxyfenozide |
Intrepid 240 SC |
SC |
IV |
0,15 - 0,18 l |
Dow AgroSciences |
|
|
|
Valient |
SC |
IV |
0,15 - 0,18 l |
Bayer |
|
|
monocrotophos |
Agrophos 400 |
SL |
I |
0,6 - 0,9 l |
Agripec |
|
|
novaluron |
Gallaxy 100 CE |
EC |
IV |
0,15 l |
Agricur |
|
|
|
Rimon 100 CE |
EC |
IV |
0,15 l |
Agricur |
|
|
parathion-methyl |
Bravik 600 CE |
EC |
I |
0,45 - 0,675 l |
Action |
|
|
|
Folidol 600 |
EC |
II |
0,45 - 0,675 l |
Bayer |
|
|
|
Folidol ME |
CS |
III |
0,7 l |
Bayer |
|
|
|
Folisuper 600 BR |
EC |
I |
0,25 - 0,65 l |
Agripec |
|
|
|
Mentox 600 CE |
EC |
II |
0,65 l |
Prentiss |
|
|
|
Paracap 450 MCS |
CS |
III |
0,7 l |
Cheminova |
|
|
|
Parathion Metílico Pikapau |
DP |
I |
0,65 l |
Químicas São Vicente |
|
|
permethrin |
Ambush 500 CE |
EC |
II |
0,05 l |
Syngenta |
|
|
|
Corsair 500 CE |
EC |
II |
0,1 l |
Aventis |
|
|
|
Permetrina Fersol 384 CE |
EC |
I |
0,1 - 0,13 l |
Fersol |
|
|
|
Piredan |
EC |
II |
0,065 l |
Du Pont |
|
|
|
Pounce 384 CE |
EC |
II |
0,065 l |
FMC |
|
|
|
Talcord 250 CE |
EC |
II |
0,1 l |
Basf |
|
|
|
Valon 384 CE |
EC |
II |
0,065 l |
Dow AgroSciences |
|
|
profenofos |
Curacron 500 |
EC |
III |
0,5 l |
Syngenta |
|
|
pyridaphenthion |
Ofunack 400 CE |
EC |
III |
0,5 l |
Sipcam |
|
|
spinosad |
Credence |
SC |
III |
0,037 - 0,1 l |
Dow AgroSciences |
|
|
|
Tracer |
SC |
III |
0,037 - 0,1 l |
Dow AgroSciences |
|
|
tebufenozide |
Mimic 240 SC |
SC |
IV |
0,3 l |
Dow AgroSciences |
|
|
thiodicarb |
Futur 300 |
SC |
III |
2,0 l /100 kg sem. |
Aventis |
|
|
thiodicarb |
Futur 300 |
SC |
III |
2,0 l /100 kg sem. |
Aventis |
|
|
|
Larvin 800 WG |
WG |
II |
0,1 - 0,15 l |
Aventis |
|
|
|
Semevin 350 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
|
triazophos |
Hostathion 400 BR |
EC |
I |
0,3 - 0,5 l |
Aventis |
|
|
trichlorphon |
Dipterex 500 |
SL |
II |
0,8 - 2,0 l |
Bayer |
|
|
|
Triclorfon 500 Milena |
SL |
II |
1,0 - 2,0 l |
Milenia |
|
|
triflumuron |
Alsystin 250 PM |
WP |
IV |
0,1 kg |
Bayer |
|
|
|
Alsystin 480 SC |
SC |
IV |
0,05 l |
Bayer |
|
|
|
Brigadier |
WP |
II |
0,1 kg |
Bayer |
|
|
|
Certero |
SC |
IV |
0,05 l |
Bayer |
|
|
|
Rigel |
SC |
IV |
0,05 l |
Cheminova |
|
|
zeta-cypermethrin |
Fury 180 EW |
EW |
II |
0,04 l |
FMC |
|
|
|
Fury 200 EW |
EW |
III |
0,08 - 0,1 l |
FMC |
|
|
|
Fury 400 CE |
EC |
II |
0,05 - 0,08 l |
FMC |
|
Syntermes molestus |
benfuracarb |
Laser 400 SC |
SC |
II |
1,75 - 2,5 l/100 kg sem. |
Iharabras |
|
|
|
Oncol Sipcam |
SC |
II |
1,75 - 2,5 l/100 kg sem. |
Sipcam |
|
|
carbofuran |
Furadan 350 TS |
SC |
I |
2,0 - 3,0 l/100 kg sem. |
FMC |
|
|
|
Furazin 310 TS |
SC |
I |
2,25 l/100 kg sem. |
FMC |
|
|
carbosulfan |
Marshal TS |
SC |
II |
2,0 - 2,8 l/100 kg sem. |
FMC |
|
|
|
Marzinc 250 TS |
DS |
II |
2,0 kg/100 kg sem. |
FMC |
|
|
imidacloprid |
Gaucho |
WS |
IV |
1 kg/100 kg sem. |
Bayer |
|
|
|
Gaucho FS |
FS |
IV |
0,4 l/100 l água |
Bayer |
|
|
terbufos |
Counter 50 G |
GR |
I |
40 kg |
Basf |
|
|
|
Counter 150 G |
GR |
I |
13 kg |
Basf |
|
|
thiodicarb |
Futur 300 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
|
|
|
Semevin 350 |
SC |
III |
2,0 l/100 kg sem. |
Aventis |
Fonte: MAPA Agrofit
O período de proteção das sementes e das plantas recém-emergidas proporcionado pelo tratamento de sementes dependerá da interação de vários fatores. Pode-se destacar os relacionados com a própria semente (tamanho, formato, textura, permeabilidade), com a natureza dos inseticidas (modo e espectro de ação, formulação, dose) e com as características do ambiente (pressão de infestação da praga, textura, temperatura e umidade do solo). Associado a esses fatores, também é importante levar em consideração a qualidade da aplicação, como o tipo de equipamento utilizado e a qualificação e capacitação do pessoal envolvido.
Dependendo da toxicidade do inseticida, o tratamento de sementes pode ser realizado na própria fazenda ou deve ser realizado em Centros de Tratamentos de Sementes ou em revendas especializadas com máquinas apropriadas e com pessoal treinado. Nas fazendas, geralmente são utilizados tambores rotativos (figura 1 abaixo), construídos especificamente para essa finalidade. No entanto, independentemente do equipamento ou inseticida utilizado, todos os cuidados devem ser tomados para evitar possíveis contaminações ou intoxicações do operador.
 |
| Figura 1: Tambores rotativos para tratamento de sementes Foto: Paulo Afonso Viana |
No caso da semente de milho, a eficiência na distribuição da semente tratada no sulco de semeadura pode ser melhorada com a adição de grafite em pó. Isso se deve ao fato de que a semente tratada com inseticida apresenta uma alteração em sua forma original, muitas vezes trazendo como consequência maior dificuldade de escoamento dentro do compartimento da semeadora. Nesse caso, o uso de grafite melhora o escoamento das sementes tratadas, especialmente em sistemas de distribuição através de discos. Por outro lado, o excesso de grafite, colocado nos sistemas de dedos (garras), tem funcionado de maneira contrária. A quantidade recomendada de grafite varia de acordo com o tamanho da semente. Sementes maiores demandam uma maior quantidade. Em média, recomenda-se cerca de 2 a 4 gramas de grafite em pó por quilo de sementes tratadas.
Como recomendação final, sugere-se que as sementes tratadas não sejam armazenadas e que se faça a semeadura em poucos dias após o tratamento. Os inseticidas, geralmente, não afetam a germinação de sementes de alta qualidade. Entretanto, sementes de qualidade inferior podem ter o vigor afetado e, consequentemente, reduzir o número de plantas na lavoura. Deve-se também evitar que as sementes fiquem descobertas no sulco de plantio, pois são tóxicas para pássaros e outros animais.
Seletividade de inseticidas
No passado, a escolha de determinado inseticida para uso contra as pragas da agricultura era baseada na capacidade de o produto químico atuar rapidamente e sobre diferentes espécies de pragas. Geralmente, eram produtos de amplo espectro de ação e, invariavelmente, altamente tóxicos. Por apresentarem custo relativamente baixo, tais produtos químicos eram considerados como uma espécie de seguro para a produção de alimentos. Eram utilizados independentemente da necessidade. No entanto, com o passar dos anos foi fácil verificar os efeitos danosos dos produtos para a natureza como um todo. E, especialmente em relação ao método de controle em si, começaram-se a aparecer raças resistentes de pragas e até mesmo novas pragas, anteriormente presentes, porém em nível populacional baixo em virtude da ação de diferentes agentes de controle natural.
Atualmente, o conceito de controle químico tem mudado. Há uma preocupação crescente não só pela sociedade, mas também pelo próprio agricultor, com o uso indiscriminado de produtos químicos. Tem-se buscado, inclusive pelas empresas produtoras de inseticidas, produtos que sejam menos danosos ao ambiente. Tem-se, portanto, buscado a seletividade dos produtos. Tal seletividade pode ser alcançada através do produto em si. Por exemplo, produtos que atuem somente sobre determinados grupos ou sobre determinadas fases da fisiologia dos insetos (inseticidas fisiológicos). A seletividade também pode ser alcançada através de aplicações dirigidas. Por exemplo, a aplicação de inseticidas para o controle da lagarta-do-cartucho na planta de milho posicionando o bico do pulverizador de modo a aplicar o produto somente na área desejada é mais seletiva do que a aplicação via água de irrigação (que é uma aplicação em área total).
De maneira semelhante, o tratamento de sementes é mais seletivo do que a pulverização em função da formulação do produto e do modo de utilização. A seletividade também pode ser em relação a determinados inimigos naturais. Por algum mecanismo próprio do inseto, ele pode não ser afetado drasticamente por determinado produto químico. Tais produtos devem ser preferidos em programas de manejo.
Aplicação de inseticidas via água de irrigação
Define-se como insetigação a aplicação de inseticidas via água de irrigação. Na insetigação, o sistema de irrigação por aspersão tem sido o método mais utilizado para a aplicação dos inseticidas. A técnica iniciou-se na América do Norte na década de 1960 visando o controle de pragas foliares com a utilização dos inseticidas azinphos methyl e carbaryl para o controle de insetos-praga na cultura do milho. No Brasil, a insetigação começou a ser utilizada na década de 1980, havendo grande escassez de informações técnicas para as nossas condições. Atualmente, com a expansão de áreas agrícolas irrigadas, tem-se utilizado aplicações de inseticidas via irrigação por aspersão, muitas das vezes sem se conhecer parâmetros técnicos necessários para se obter a melhor eficiência e reduzir os riscos oriundos de qualquer utilização de defensivos agrícolas.
A insetigação tem sido utilizada com sucesso para o controle de diversas pragas e culturas. Entretanto, existem exemplos de insucessos, indicando que o método não se aplica para todas as condições. As doses dos inseticidas aplicados na insetigação são as mesmas utilizadas em pulverizações com os métodos convencionais (tratorizada ou costal). As primeiras avaliações de inseticidas na insetigação fundamentaram-se nos princípios ativos que apresentavam eficiência comprovada através de pulverização para o controle de determinada praga.
Vários parâmetros são relevantes para se obter uma boa eficiência na insetigação e evitar riscos, destacando-se as condições ambientais (velocidade do vento, umidade relativa, precipitação pluviométrica), tipo e umidade do solo, seleção de inseticidas (solubilidade em água, dose), volume, qualidade e velocidade do fluxo de água e compatibilidade de produtos. Na utilização da insetigação, devem ser tomadas medidas contra aplicações indiscriminadas de inseticidas, ter cuidados no manuseio de inseticidas que, em sua maioria são inflamáveis, utilizar equipamentos de segurança adequados, evitar deriva e não entrar na área logo após a mesma ser tratada.
O emprego dessa técnica tem sido pesquisada na Embrapa Milho e Sorgo para o controle da lagarta-do-cartucho, Spodoptera frugiperda, lagarta-da-espiga, Helicoverpa zea, lagarta elasmo, Elasmopalpus lignosellus, e larva-alfinete, Diabrotica speciosa. Os resultados indicam que essas pragas podem ser controladas empregando os inseticidas aplicados via água de irrigação por aspersão mostrados na Tabela 2.
Tabela 2. Inseticidas com melhores performances para o controle de insetos-praga de milho aplicados via irrigação por aspersão. EMBRAPA/CNPMS.
| Insetos-praga | Inseticida (i.a.) | Dose (i.a./ha) | Lâmina de água (mm) |
| Lagarta-do-cartucho | chlorpyrifos | 288 | 6 mm |
| Lagarta-elasmo | chlorpyrifos | 480 | 10 mm |
| Larva-alfinete | chlorpyrifos | 480 | 10 mm |
| Lagarta-da-espiga | cyfluthrin | 15 | 10 mm |
Fonte: Paulo Afonso Viana
Os inseticidas podem ser aplicados utilizando equipamentos convencionais de irrigação (tipo lateral portátil) ou através de pivô. Para o equipamento convencional, a calda inseticida pode ser injetada no sistema de irrigação através de bomba dosadora ou de um equipamento portátil de injeção desenvolvido na Embrapa Milho e Sorgo denominado "vaquinha" (figura 2 abaixo). Para o pivô central, utiliza-se a bomba dosadora. Independentemente do método de injeção adotado, a qualidade dos resultados obtidos na aplicação depende do cálculo correto de variáveis como taxa de injeção, quantidade do inseticida a ser injetada, volume do tanque de injeção e dose do inseticida a ser aplicada na área irrigada.
 |
| Figura 2. Equipamento portátil de injeção desenvolvido na Embrapa Milho e Sorgo denominado "vaquinha" Foto: Paulo Afonso Viana |
Desde o início de sua utilização, a insetigação tem adaptado tecnologias existentes, tanto na parte de equipamentos ou dos químicos a serem aplicados. No futuro, novas formulações de inseticidas deverão ser desenvolvidas para essa modalidade de aplicação, visando obter maior eficiência no controle das pragas. Pesquisas deverão ser conduzidas objetivando reduzir a quantidade de inseticidas aplicados nas lavouras, com reflexos diretos nos custos de produção e de contaminação ambiental. A indústria deverá desenvolver equipamentos de alta eficiência tanto para a irrigação como para a aplicação de produtos químicos. A melhoria da eficiência do controle de pragas poderá também ser obtida com novos aspersores, tanques e depósitos para a mistura da calda inseticida e microprocessadores para controlar a irrigação e a injeção.
Controle biológico: papel dos inimigos naturais no controle das pragas
Em função da importância de insetos-praga da ordem Lepidoptera (mariposas, especialmente) como pragas da cultura do milho no Brasil e também em relação ao aparecimento de populações resistentes aos inseticidas, como é o caso da lagarta-do-cartucho, as pesquisas com controle biológico têm aumentado no país. Deve-se considerar que, em certas circunstâncias, os inimigos naturais podem diminuir consideravelmente a população da praga no campo.
São importantes inimigos naturais das principais pragas do milho diferentes espécies de insetos chamados parasitóides, cujas larvas se desenvolvem dentro dos ovos ou das lagartas da praga. Também são de igual importância os chamados insetos predadores e, talvez, o representante mais importante e facilmente percebido no campo seja a chamada "tesourinha", presente no cartucho da planta ou na espiga. Além das tesourinhas, são conhecidas como espécies benéficas as joaninhas, os crisopídeos e os percevejos predadores. O reconhecimento dessas espécies benéficas pode ajudar o agricultor a tomar a medida mais correta e econômica para o manejo das espécies de praga no cultivo de milho.
Todos esses inimigos naturais geralmente estão presentes na cultura do milho em áreas onde se pratica o MIP (Manejo Integrado de Pragas). Podem ser utilizados sozinhos ou integrados a outros métodos de controle.
Dos parasitóides, dois atuam exclusivamente sobre os ovos da praga, impedindo a eclosão da lagarta e, portanto, não permitindo dano algum à planta de milho: Trichogramma spp. e Telenomus remus (figuras 3 e 4 abaixo). São insetos facilmente criados no laboratório, a um custo inferior ao do produto químico padrão. Esses inimigos naturais já estão sendo liberados em áreas comerciais, em diferentes regiões do Brasil, com sucesso. Há, inclusive, disponibilidade comercial desses agentes de controle biológico no Brasil. O ciclo total dessas vespas varia entre 10 e 12 dias.
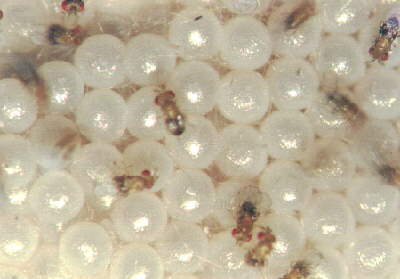 |
| Figura 3.Parasitóide de ovo, Trichogramma pretiosum Foto: Ivan Cruz |
 |
| Figura 4. Parasitóide de ovo, Telenomus remus Foto: Ivan Cruz |
A vespa Chelonus insularis (figura 5 abaixo) é de ocorrência comum no Brasil. A fêmea coloca seus ovos no interior dos ovos da praga, mas permite a eclosão das lagartas. No entanto, a lagarta parasitada não provoca danos significativos ao milho, pois ela aos poucos vai sendo consumida internamente pela larva da vespa. O ciclo biológico total do parasitóide é de 28 dias, distribuídos em um período de incubação de 1,8 dias, período larval de 20,4 dias e período pupal de 6,2 dias. A lagarta parasitada sai precocemente do cartucho, dirigindo-se para o solo, onde constrói uma câmara. Após a construção desta câmara, a larva do parasitóide perfura o abdômen da lagarta-do-cartucho e, dentro da câmara, constrói seu casulo e transforma-se em pupa.
 |
| Figura 5. Parasitóide de ovo-larva, Chelonus insularis Foto: Ivan Cruz |
Campoletis flavicincta (Figura 6) é uma outra espécie de inseto benéfico medindo cerca de 7 mm de comprimento que coloca seus ovos no interior do corpo da lagarta-do-cartucho quando esta é recém-nascida. Uma só fêmea pode parasitar mais de 200 lagartas. O ciclo biológico completo do inseto é de 16,5 dias. Dentro da lagarta-do-cartucho, o parasitóide passa cerca de 9,6 dias. A lagarta parasitada reduz significativamente o alimento ingerido. Próximo à saída da larva do parasitóide, o inseto parasitado sai do cartucho da planta e dirige-se para as folhas mais altas da planta. Neste local, fica praticamente imóvel até ser morto pelo parasitóide que perfura seu abdômen.
 |
| Figura 6. Campoletis flavicincta Foto: Ivan Cruz |
A tesourinha Doru luteipes (figura 7 abaixo) tem presença constante na cultura do milho. Tanto os imaturos quanto os adultos alimentam-se de ovos e de lagartas pequenas da praga. Um adulto do predador pode consumir cerca de 21 larvas pequenas por dia. Os ovos da tesourinha são colocados dentro do cartucho da planta, sendo que uma postura possui, em média, 27 ovos. O período de incubação dura cerca de sete dias. As ninfas, à semelhança dos adultos, são também predadoras. A fase ninfal dura em torno de 40 dias. Os adultos podem viver quase um ano. A presença do predador em até 70% das plantas de milho é suficiente para manter a praga sob controle.
 |
| Figura 7. Tesourinha Doru luteipes Foto: Ivan Cruz |
A conscientização de que os inimigos naturais podem ser aliados importantes no manejo de pragas tem forçado a busca de inseticidas e/ou aplicações mais seletivas. No caso específico da cultura de milho, a tesourinha, por sua importância no controle biológico da praga, além de todas as suas formas biológicas estarem intimamente ligadas ao cartucho da planta, é o inseto mais sujeito à ação dos produtos químicos. Por essa razão, tem-se avaliado o impacto de diferentes formulações e doses dos produtos sobre suas fases. De maneira geral, o inseto adulto é mais tolerante aos produtos químicos, especialmente àqueles que também apresentam baixo impacto ambiental. A sensibilidade desse e de outros inimigos naturais, bem como os critérios para a escolha de um produto químico para uso no manejo integrado em milho, foram abordados por Cruz (1997).