Agricultura e Meio Ambiente
Cloroanilinas
Autor
Itamar Soares de Melo - Embrapa Meio Ambiente
A remoção de pesticidas de água tem sido estudada usando vários métodos incluindo células ou enzimas imobilizadas, biofilmes fixados, e colunas de solo. As bactérias, especialmente as cianobactérias (incluindo as fixadoras de N2), exibem capacidade de degradação de compostos aromáticos em águas superficiais.
Diante da probabilidade de contaminação de solos, sedimentos e águas superficiais, por pesticidas à base de cloroanilinas, principalmente em arrozais, é que se estuda: a) o potencial das cianobactérias serem utilizadas na remediação dessas moléculas; b) as vias metabólicas da degradação das anilinas por cianobactérias; c) as propriedades de adsorção físico-químicas e de ligação química; e, d) os efeitos de diferentes pesticidas à base de cloroanilinas nas populações bacterianas de solos alagados.
Biodegradação de pesticidas à base de cloroanilinas
As cloroanilinas são utilizadas na manufatura de muitos herbicidas, plásticos e produtos farmacêuticos. Elas podem ser liberadas ao meio ambiente tanto pela própria decomposição dos produtos mencionados, como pela transformação de nitrocompostos aromáticos em derivados com grupos amino (por isso é comum a presença de anilina em solos contaminados com nitrobenzeno). As cloroanilinas têm ainda a propriedade de adsorção físico-química e de ligação química com as substâncias húmicas presentes no solo, podendo permanecer indetectáveis por anos após a aplicação dos herbicidas. Além da formação dos complexos ácidos húmicos anilinas, as cloroanilinas liberadas podem estar sujeitas à dimerização (ligação de duas unidades da mesma molécula) e polimerização ( n unidades de estruturas ligada entre si) para formar compostos azo, isto é, à base de nitrogênio altamente estáveis e resistentes à mineralização. De um modo geral, a biodegradação de anilinas é realizada por bactérias, sendo as mais conhecidas pertencentes ao gênero Pseudomonas. Outras bactérias, como várias espécies de Rhodococcus, parecem apenas transformar as anilinas sem, contudo, mineralizá-las a CO2 e NH3. Em estudos foram examinados a degradação de 2-,3- e 4-cloroanilina e 3,4 dicloroanilina, mostrando que a biodegradação e a adsorção das cloroanilinas seguiram em paralelo quando as anilinas tinham sido recém adicionadas em amostras de solo.
Foto: Itamar Soares de Melo
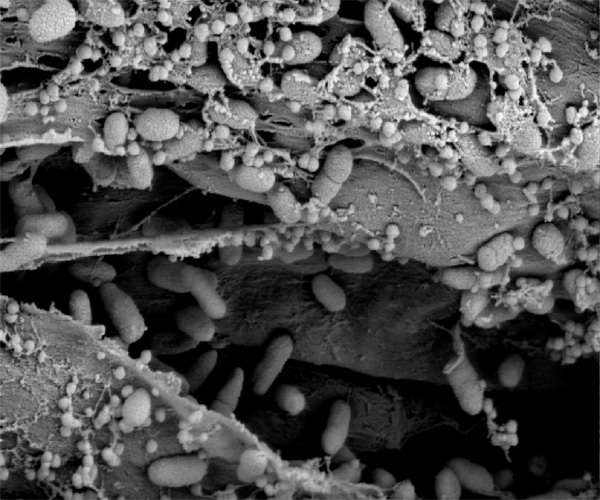
Figura 1. Pseudomonas
O modo pelo qual as anilinas são degradadas tem sido alvo de inúmeros trabalhos. Em alguns estudos foi observada a necessidade de oxigênio molecular para o primeiro estágio da degradação, sendo então assumido que a metabolização deve ser catalisada por oxigenases (p. ex. anilina oxigenase). De uma maneira consensual todos os trabalhos apresentam evidências da importância das catecolases, isto é, enzimas que hidrolizam catecóis, (catecol 1,2 e catecol 2,3 dioxigenase) para os subseqüentes estágios da degradação das anilinas. Durante estudo de mineralização de 2- e 3- cloroanilinas através de células de bactérias imobilizadas foi monitorada a atividade de catecóis dioxigenases, sendo encontrada apenas a atividade de catecol 1,2 dioxigenase. Em trabalhos realizados, foram examinadas diferenças de vários parâmetros metabólicos entre dois regimes de crescimento microbiano: inibido e não inibido por anilinas. Durante o experimento, monitararam atividade de catecol 2,3 dioxigenase. O estudo do mecanismo regulatório indicou que a enzima seria inibida não competitivamente pela anilina e que também estaria sujeita à inibição por feedback pelo semialdeído 2 hidroximucônico.
Já o mecanismo de clivagem orto, mais freqüentemente encontrado na degradação de anilinas, fenóis e benzoatos por microorganismos, geralmente se mostra ineficiente no processo de degradação dos análogos clorados.
Outro estudo sobre as vias metabólicas de anilinas admite que cerca de 92% dos microorganismos isolados do solo e crescidos em anilina como única fonte de carbono, metabolizam a anilina via mecanismo de clivagem orto, enquanto os 8% restantes seguiriam mecanismos de clivagem meta. Dentro destas vias metabólicas, a catecol 1,2- dioxigenase e a catecol 2,3 dioxigenase seriam, respectivamente, as enzimas-chaves para o catabolismo de compostos aromáticos monocíclicos, catalisando clivagens intradiol e extradiol do catecol.
Trabalhos sobre a biodegradação de anilinas presentes em ecossistemas aquáticos sugerem que bactérias presentes nestes sistemas podem ter um papel tão importante quanto o dos microorganismos do solo, e que a velocidade da biodegradação de anilina é mais rápida em ambientes poluídos graças à adaptação da microflora da água.
Biodegradação foi o modo mais significante de remoção de anilina em água de lago e sua mineralização foi acelerada quando amostras foram inoculadas com lodo. A principal via de degradação envolveu reação oxidativa a catecol seguido pela fusão do anel. Processos fotoquímicos em amostras de água de um lago eutrófico (lago em cujas águas os nutrientes minerais e orgânicos são abundantes e o oxigénio escasseia, tornando difícil a existência de vida animal) foram responsáveis pela maioria da mineralização de 2,4,5 tricloroanilina, um metabólito na degradação de um grande número de feniluréia e fenilcarbamato. Somente 19% do 14C-2,4,5-t foi mineralizado por processos biológicos e estes foram atribuídos à atividade bacteriana.
Degradação de pesticidas por cianobactérias
Microrganismos fototróficos isto é, aqueles que obtêm sua energia a partir da energia luminosa, pela fotossíntese, também exibem capacidade para degradar pesticidas, incluindo aqueles aplicados na água de irrigação. Recentemente grande atenção tem sido voltada para elucidar a participação de microrganismos fototróficos na degradação de poluentes orgânicos, tanto em água como no solo. A capacidade de degradar hidrocarbonetos aromáticos policíclicos tem sido verificada em muitas espécies de cianobactérias, como: Anabaena sp., Oscillatoria sp., Microcoleus chtonoplastes, Nostoc sp., Agmenellum quadruplicatum, Aphanocapsa sp., e Coccochloris elebens. Tanto cianobactérias como algas eucarióticas são capazes de usar compostos aromáticos, como: naftaleno, metilnaftaleno, fenantreno, befenil e anilina durante seu crescimento como fontes de carbono.
Foto: Itamar Soares de Melo
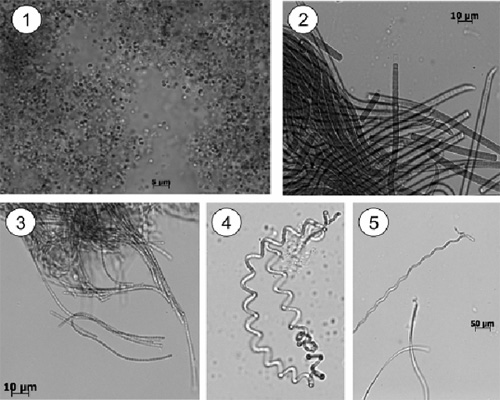
Figura 2. Cianobactérias
As cianobactérias Agmenellum quaduplicatum e Oscillatoria sp. oxidam naftaleno predominantemente a 1-naftol pelo mesmo mecanismo daquele descrito para microrganismos eucarióticos, isto é, micorganismos de uma célula bem formada com núcleo, citoplasma e membrana. Ao mesmo tempo, em filtrados de cianobactérias, cis-1,2-dihidroxil 1,2-dihidronaphtaleno, um intermediário comum do metabolismo bacteriano do naftaleno é encontrado. Isso prova a presença de múltiplos passos para o metabolismo de hidrocarbonos aromáticos em cianobactérias.
Cianobactérias e algas são capazes de acumular em suas células e degradar pesticidas. Assim, muitas algas podem transformar DDT em DDE - que é um metabólito do DDT. A cianobactéria A. variabilis e Phormidium forveolarum assim como a alga verde-amarela Chloridella simplex são capazes de degradar simazina. A alga verde Chlorella vulgaris degrada simazina, patoran e methobromuron. Estas algas consomem ativamente e acumulam simazina radiomarcada em quantidades que excedem cem vezes sua concentração no ambiente.
Foto: Itamar Soares de Melo

Figura 3. Cianobacterias
A capacidade de absorção de simazina alcança 480 mg/kg, fornecendo assim, considerável contribuição para migração e transformação deste composto. Tem também sido comprovado que algas podem parcialmente metabolizar simazina a produtos solúveis em água. A alga C. vulgaris transforma rapidamente p-bromoanilina em acetanilida dentro de 3-10 dias.